Метод сибирских ученых приблизит разработку вакцины против ВИЧ
Сайт Наука в Сибири 16 октября 2019 г.
Информационное агентство Regnum 16 октября 2019 г.
Информационное агентство Интерфакс 16 октября 2019 г.
Сайт Популярная Механика 16 октября 2019 г.
Сайт Наш Дом Новосибирск 16 октября 2019 г.
Сайт Сибнет. Новости 16 октября 2019 г.
Сайт Вести. Новосибирск 17 октября 2019 г.
Газета Наука в Сибири №41 (3202) от 17 октября 2019 г.
Сайт Indicator.ru 18 октября 2019 г.
Сотрудники Института молекулярной и клеточной биологии СО РАН предложили простой и эффективный способ получения антител из одиночных B-лимфоцитов. Это поможет существенно сократить время и затраты на создание вакцин против большинства вирусных и бактериальных агентов, в том числе против ВИЧ. Статья об этом опубликована в журнале BioTechniques.

кбн СВ Гусельников, кбн АА Гopчaкoв
Иммунная система человека способна распознавать и уничтожать различные патогены, проникающие в организм: вирусы, бактерии, грибки, паразиты, а также собственные дефектные клетки, например опухолевые. Такая специфическая реакция на чужеродный агент (антиген) осуществляется клетками иммунной системы — лимфоцитами.
В-лимфоциты играют важную роль в приобретенном иммунном ответе: они синтезируют белковые молекулы (иммуноглобулины, или антитела) против конкретных чужеродных структур и выделяют их в кровь. Эти молекулы присоединяются к антигенам, благодаря чему последние опознаются как чужеродные и в дальнейшем уничтожаются.
“Мы не можем узнать заранее, с какими заболеваниями столкнемся, но нам это и не нужно: наши B-лимфоциты способны продуцировать антитела против очень многих патогенов. Если человек однажды встретился с любым из них, в его организме остаются так называемые клетки памяти от перенесенного заболевания. Выделив из таких клеток ДНК генов иммуноглобулинов, мы можем получить антитела против любого чужеродного вещества, будь то вирус, бактерия, грибок или опухолевая клетка. В дальнейшем их можно использовать для лечения других людей”, — рассказывает старший научный сотрудник лаборатории иммуногенетики ИМКБ СО РАН кандидат биологических наук Сергей Владимирович Гусельников.
По словам исследователя, более 40 лет назад для диагностики и лечения вирусных и бактериальных инфекций была изобретена технология, которая позволила выделять гены иммуноглобулинов из индивидуальных B-клеток животных — мышей, кроликов, обезьян — и на их основе производить антитела против некоторых болезней: ВИЧ, гепатита, малярии и даже лихорадки Эбола. Конечно, лечить человека просто антителами, например мыши, постоянно нельзя — против них может развиться вторичный иммунный ответ. “Поэтому усилия медиков и биологов были направлены на получение химерных антител,— “сшитых” из мышиных и человеческих, — а также гуманизированных, в которых изначально взятые у мыши некоторые фрагменты, необходимые для борьбы с недугом, были заменены на человеческие. Последние 10-15 лет фокус внимания ученых сместился на получение полностью человеческих антител: именно они лучше всего подходят для создания терапевтических препаратов и вакцин”, — комментирует старший научный сотрудник лаборатории иммуногенетики ИМКБ СО РАН кандидат биологических наук Андрей Александрович Гopчaкoв.
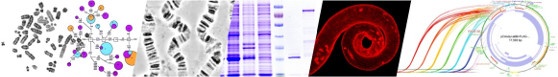
Один из способов получения таких антител в условиях лаборатории — выделять из организма донора B-клетки, которые вырабатывают антитела против нужного патогена, выявлять их генетический паспорт и размножать. “Наши коллеги из московского Института иммунологии под руководством профессора, доктора биологических наук Александра Васильевича Филатова развивают технологию, позволяющую из единичной B-клетки, выделенной из организма, получить миллионы ее копий и таким образом создать готовую клеточную культуру, производящую антитела, — говорит Сергей Гусельников. — Мы развиваем другой вариант этой технологии: выделяем единичные В-клетки, жизнеспособные и нет, инапрямую определяем последовательность ДНК в их генах иммуноглобулинов, отдельно для тяжелых, отдельно для легих цепей антитела. Казалось бы, несложно, однако на практике установить последовательности обеих цепей антител удается лишь для 30—70 % одиночных В-клеток, даже в очень солидных зарубежных молекулярно-генетических лабораториях”.
Новосибирские биологи нашли способ повысить это количество до 90-100 %. Сергей Гусельников уточняет, что найти B-лимфоциты памяти с заданной специфичностью — сложная задача, потому что в организме их крайне мало. “Наш подход позволяет с высокой степенью вероятности извлекать необходимые иммунные клетки всего из 1—2 мл крови”, — говорит исследователь. Для этого ученые помечают их интересующим белком-мишенью. “Редкие В-клетки памяти могут образовывать антитела к этому агенту, и часть находится у них на поверхности. Если мы ищем антитела против условного “белка икс”, то B-клетка с этим белком крепко свяжется. Мы помечаем белок, к примеру, зеленой флуоресцентной краской. Он облепляет нужную В-клетку, и она тоже становится зеленой. Принцип примерно такой же, как у рыбалки: мы ловим рыб на очень изысканную наживку, которая по вкусу только одному их виду. Окрашенные клетки — и только их — мы затем сортируем по индивидуальным пробиркам, после чего начинается магия ПЦР”, — поясняет Андрей Гopчaкoв.
Полимеразная цепная реакция, или ПЦР — метод молекулярной биологии, который позволяет легко и многократно увеличить число интересующих фрагментов ДНК в пробе. Чтобы выяснить, какая последовательность ДНК в данной индивидуальной клетке кодирует антитело, специфически узнающее мишень, ученые должны вначале превратить РНК в так называемую комплиментарную ДНК (кДНК), и только после этого провести ПЦР. ПЦР можно ставить и с ДНК напрямую, но это менее эффективно, так как в кажой пробирке находится всего одна крохотная В-клетка, а в каждой клетке — только одна молекула ДНК с перестроенными генами иммуноглобулинов, в то время как молекул матричной РНК (а значит потом и комплиментарной ДНК) — на несколько порядков больше.
ПЦР с индивидуальных клеток получается далеко не каждый раз. “Это можно сравнить с походом в казино: получил ПЦР-продукт — выиграл, нет — проиграл. Если получил ПЦР-продукт сразу и для тяжелой, и для легкой цепи — бинго! — у тебя есть вся информация для синтеза антитела. Сергей предложил не использовать весь объем комплиментарной ДНК целиком для одной реакции, как это делается традиционно, а разделить на три части — грубо говоря, сделать не две (одну для легкой и одну для тяжелой цепи), а шесть ставок в казино. Сначала для тяжелой цепи: не получилось — не получилось — получилось. Потом для легкой: не получилось — получилось — не получилось. В обоих случаях ты хоть раз, да выиграл. Этого уже достаточно для того, чтобы выйти из казино победителем”, — отмечает Андрей Гopчaкoв.
“Благодаря этой простой процедуре в экспериментах, приведенных в качестве примера в нашей статье, мы получили полную информацию о строении антител для 21 из 24 выделенных В-клеток, то есть почти для всех”, — говорит Сергей Гусельников.
“Мы работаем с B-клетками, полученными исключительно из крови здоровых доноров, — подчеркивает Андрей Гopчaкoв. — Да, антитела против ВИЧ, способные нейтрализовать большинство вариантов ВИЧ-1, найдены, — но у больных людей, а чтобы они появились у здорового человека, нужно сильно постараться. И мы стараемся. Чем о большем числе B-клеток, способных формировать антитела против ВИЧ-1, мы получим информацию, тем лучше”.
Конечная цель ученых — дойти до клинических испытаний. “Нам важно посмотреть, есть ли в крови незараженного человека B-клетки, которые взаимодействуют с интересующим нас антигеном. Специально для этого мы разработали наживку, с помощью которой надеемся поймать предшественника широко нейтрализующих антител против ВИЧ-1. Если в дальнейшем мы обнаружим у здорового человека необходимое количество B-лимфоцитов, которые обладают нужными свойствами (несут именно те гены иммуноглобулинов, на которые мы рассчитываем), то у нас есть основания на следующем этапе уже переходить к испытаниям — сначала на мышах и обезьянах, а в перспективе и на людях”, — акцентирует Сергей Гусельников.