Наука дает шанс: молекулярная биология в медицине
Сайт Биомолекула.ру 26 октября 2016 г.
Научно-популярный сайт Биомолекула в очередной раз опубликовал работу сотрудников ИМКБ. Статья Ирины Грищенко из Сектора хромосомных патологий посвящена Синдрому ломкой X-хромосомы
Полвека назад возникла и начала стремительно развиваться молекулярная биология. Биологи и физики (обычный для середины двадцатого века союз) открыли важнейшие клеточные процессы, изобрели основные методы, без которых сегодня немыслима работа любой биологической лаборатории. Сейчас у нас есть громадный потенциал для решения всевозможных задач: прояснения аспектов происхождения жизни, изучения взаимодействий компонентов в живой клетке и сложных биохимических каскадов. Мы знаем и умеем то, что еще лет 60 назад казалось фантастикой. И одна из задач, на решение которой уже могут покуситься ученые, — это борьба с наследственными заболеваниями человека. Некоторые из них, такие как фенилкетонурия, успешно корректируются, подходы к терапии множества других еще не найдены. В этой статье пойдет речь об одном из таких заболеваний — синдроме ломкой X-хромосомы — и о сложностях его изучения.
Экспансия повторов. Новый тип мутаций — причина давно известных заболеваний
В начале 20 века ученые заметили, что умственная отсталость чаще поражает мужчин. В 1934 году ирландский врач Джеймс Мартин и английский генетик Джулия Белл впервые описали семью, где умственная отсталость наследовалась сцепленно с полом. В этой семье было 11 мужчин-олигофренов и две женщины с легкой степенью умственной отсталости. Обнаруженную семейную форму заболевания назвали синдромом Мартина-Белл. Через 35 лет Герберт Лабс, проводя цитогенетическое исследование, выявил в кариотипе четырех слабоумных мужчин и трех нормальных женщин (из трех поколений одной семьи) странную Х-хромосому, которую он назвал маркерной: ближе к концу длинного плеча у нее была вторичная перетяжка. Лабс предложил отслеживать маркерную хромосому у эмбрионов мужского пола в неблагополучных по синдрому Мартина-Белл семьях, поскольку она может сигнализировать о высоком риске рождения олигофренов (рис. 1) [1]. Так медики обрели первый пренатальный маркер синдрома, а их пациенты — возможность принятия взвешенного решения о сохранении беременности. Маркерную перетяжку локализовали на участке Xq27.3.
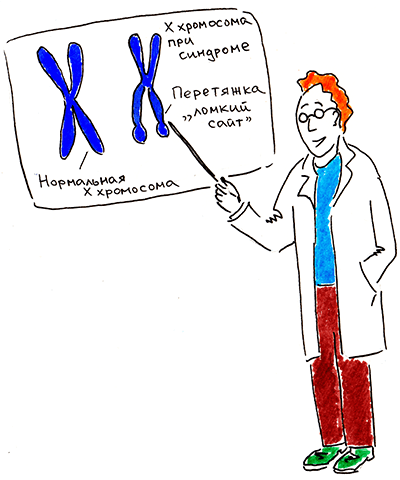
Рисунок 1. Герберт Лабс рассказывает коллегам о перетяжке на X-хромосоме при синдроме Мартина-Белл.
Позже многие исследователи наблюдали под микроскопом Х-хромосомы не просто с перетяжкой, а как бы поломанными — с «оторванными» кончиками длинных плеч. Место перетяжки/поломки стали называть ломким сайтом (fragile site). Поэтому заболевание получило другое название — синдром ломкой X-хромосомы (fragile X syndrome).
Еще одна интересная особенность этого заболевания — усугубление болезни в каждом последующем поколении (генетическая антиципация). Этот феномен объяснили только в последнем десятилетии 20 века, после открытия особого типа мутаций — экспансии тринуклеотидных повторов.
Если классифицировать заболевания по патогенетическим механизмам, то довольно большую группу составят болезни, обусловленные экспансией повторов [2]. Суть мутации заключается в следующем: в человеческом геноме встречаются короткие участки (например, триплеты нуклеотидов), в норме повторенные несколько раз, но по каким-то причинам их количество начинает резко расти — в десятки и сотни раз, — и общая длина «заикающегося» (содержащего повторы) фрагмента может увеличиться до нескольких тысяч пар нуклеотидов (рис. 2).
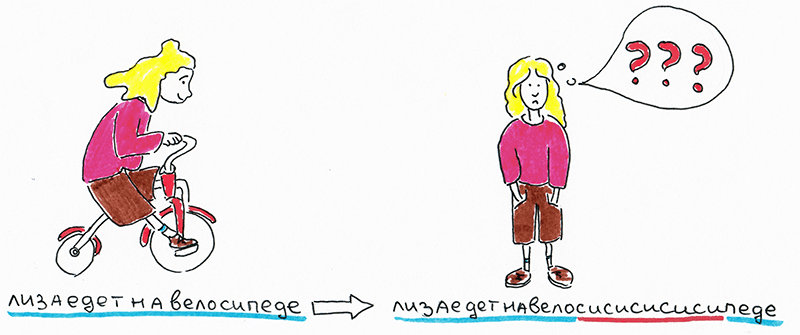
Рисунок 2. Представим, что наш геном — очень длинный текст, а происходящая экспансия превращает его в полную бессмыслицу.
Позже выяснилось, что экспансия лежит в основе патогенеза не только синдрома ломкой X-хромосомы, но и миотонической дистрофии I и II типов, а также ряда нейродегенеративных заболеваний человека — например, бокового амиотрофического склероза и болезни Гентингтона. В общей сложности известно около 30 заболеваний, для которых характерна такая мутация. Многие из этих патологий связаны с увеличением количества повторов (ЦГГ)n, (ЦАГ)n, (ГАА)n и других [3].
Причины и патогенез синдрома ломкой X-хромосомы
Синдром ломкой X-хромосомы, пожалуй, самая распространенная причина наследственной умственной отсталости после синдрома Дауна. Клинических проявлений синдрома довольно много и наблюдаются из них не все и не всегда, но основные — низкий уровень интеллекта и эмоционального развития вкупе с рядом физических отклонений, —— присутствуют чаще всего. Эти особенности заметны уже в раннем детстве.
Причина заболевания кроется в увеличении числа повторов триплета ЦГГ в области промотора (стартовой площадки для начала синтеза мРНК) гена FMR1 (рис. 3). Продуктом этого гена является белок FMRP (fragile X mental retardation protein), который взаимодействует с РНК и направляет сложные молекулярные каскады, необходимые для нормального формирования нейронов, их синаптической пластичности [4]. У здорового человека количество повторов варьирует в пределах от 5 до 54. При увеличении числа повторов до 55–200 возникает аллель, называемый премутантным. В популяции он встречается достаточно часто: у одного из 200–250 человек. Хотя уровень мРНК гена оказывается выше нормы, содержание FMRP остается неизменным или даже немного снижается. Почему это происходит — пока неизвестно. Можно предположить, что в этом участвует РНК-интерференция — процесс подавления экспрессии гена (какого-то этапа пути от нуклеотидной последовательности до конечного продукта, в данном случае — FMRP) с помощью малых РНК [5].
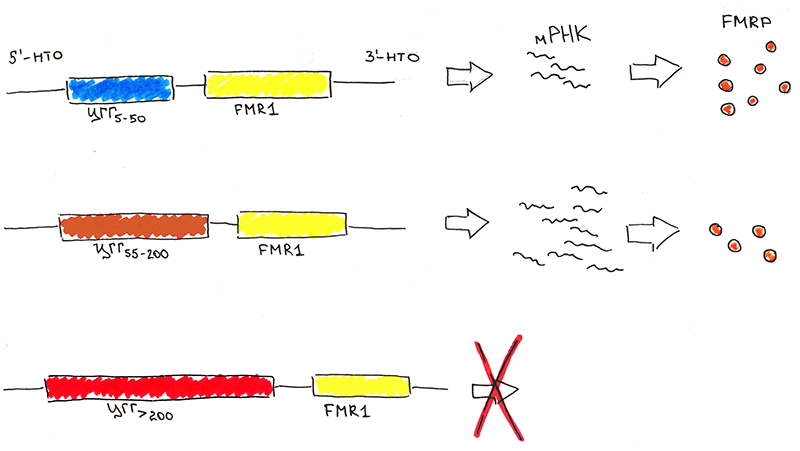
Рисунок 3. Структура гена FMR1 и схема его экспрессии. 5’-НТО и 3’-НТО — 5’- и 3’-нетранслируемые области гена.
При чуть более выраженной экспансии ЦГГ-повторов у пациентов можно обнаружить особые внутриклеточные включения, состоящие из мРНК FMR1 и РНК-связывающих белков. Это свидетельство того, что мРНК становится токсичной для клетки [6]. Интересно, что «нормальная» мРНК не оказывает токсического эффекта даже в очень высоких концентрациях. У большинства женщин — носительниц премутации, в отличие от мужчин, нет внешних проявлений патологии. В этом заслуга второй X-хромосомы, которая в большей или меньшей доле клеток компенсирует дефект. Более того, есть данные о преимущественной инактивации («выключении») именно дефектной хромосомы*. Но зачастую таким женщинам свойственны эмоциональные проблемы, депрессии и фобии.
И разумеется, даже при отсутствии внешних признаков заболевания премутантный аллель передается потомству. При этом происходит «амплификация» повтора — с каждым овогенезом всё больше и больше, вплоть до нескольких тысяч «копий». А это ведет к тому, что премутантный аллель превращается в самый что ни на есть мутантный [2, 7]. В этом случае мы говорим уже о синдроме ломкой Х-хромосомы. Его частота в популяции составляет около 1:3600–6000. Это довольно много! При таком значительном увеличении количества повторов ЦГГ происходят эпигенетические изменения: присоединение метильных групп к цитозину ЦГГ-триплетов в области промотора FMR1 и модификации белков, связанных с ДНК, — гистонов. Всё это ведет к локальному изменению плотности укладки ДНК — формированию конденсированного, неактивного хроматина, называемого гетерохроматин. Экспрессия генов, находящихся в такой зоне, подавляется. Поэтому в случае синдрома Мартина-Белл резко сокращается продукция белка FMRP. Более того, модификации хроматина вызывают визуальную «ломкость» хромосомы в районе Xq27 — ту самую, которую наблюдали ученые еще в середине 20 века. Правда, справедливости ради надо отметить, что у пары процентов больных синдром обусловлен не экспансией ЦГГ-повторов, а другими мутациями гена FMR1.
Итак, судя по всему, патогенетические механизмы у синдрома ломкой X-хромосомы и других «экспансивных» заболеваний общие: для всех них характерно какое-то критическое количество триплетов, при котором ген еще функционирует нормально. Причины самόй экспансии до конца не ясны. На сегодняшний день предложено множество гипотез и моделей, пытающихся ее объяснить, например, нарушениями при репликации, проблемами с системами репарации, и т.д. Однако пока ни одна из них не нашла экспериментального подтверждения.
Почему сложно диагностировать экспансию и как эту проблему решают?
Как уже упоминалось, синдром ломкой X-хромосомы далеко не единственное заболевание, проявляющееся умственной отсталостью. Но накопленные знания помогли разработать достаточно подробную методику диагностики именно этого синдрома. Есть возможность выявить даже премутацию у людей с нормальным фенотипом (с нормальным уровнем IQ и без аномалий развития) [10]. Это очень важно, поскольку у женщин-носительниц высок риск появления детей с выраженным синдромом. Правда, эта методика не лишена недостатков и, к сожалению, не применяется широко, поэтому разработке методов молекулярной диагностики до сих пор отводится особое место.
Первоначально проводили исследование хромосомного набора пациента — кариотипирование, — и при обнаружении повреждений в участке Xq27.3 ставили диагноз. Это и сегодня является первым, что делают врачи-генетики — по крайней мере, в России. Проблема кариотипирования заключается в том, что этот метод недостаточно чувствителен, а значит, не слишком надежен. Поэтому всё чаще для постановки диагноза применяют более современные методы. Существуют тест-системы для ДНК-диагностики, основанные на ключевых методах молекулярной биологии: ПЦР (рис. 4), Саузерн-блоте, иммунопреципитации и др. Они позволяют оценить количество белка FMRP и его мРНК, определить число ЦГГ-повторов и уровень метилирования цитозина в промоторе гена FMR1. Это, в свою очередь, помогает лучше понять патофизиологию синдрома, потому что можно соотнести результаты анализа с фенотипом пациентов и носителей премутации.
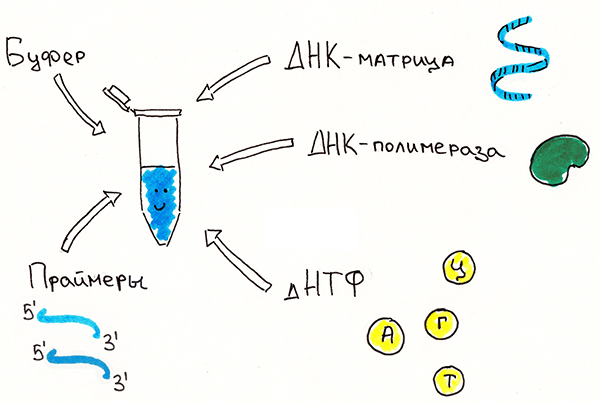
Рисунок 4. ПЦР — полимеразная цепная реакция, один из стандартных методов молекулярной биологии, применяемых в диагностике. Показаны основные компоненты, без которых реакция не пойдет. ДНК-матрица — молекула ДНК, участок которой нужно многократно размножить (амплифицировать). Праймеры — олигонуклеотиды, комплементарные концам (на разных цепях) интересующего участка ДНК-матрицы, как бы ограничивающие его, — выполняют функцию затравки для фермента, копирующего ДНК (ДНК-полимеразы). дНТФ — дезоксирибонуклеозидтрифосфаты — строительный материал для новой молекулы ДНК. Буфер — раствор солей, обеспечивающий необходимые условия (pH, ионную силу); он обязательно содержит соль магния, потому что только в присутствии ионов Mg2+ работает ДНК-полимераза. Если все компоненты смешать, поместить в прибор под названием амплификатор (циклер) и запустить нужную программу циклического повышения-снижения температуры, на матрице исходных единичных молекул ДНК синтезируются тысячи копий интересующего участка, который в итоге будет легко изучать. Если же из-за каких-то мутаций изменятся последовательности, в норме комплементарные праймерам, либо радикально увеличится расстояние между ними, ПЦР-продукта просто не будет.
ПЦР — основной метод диагностики. Он позволяет наработать область, содержащую (ЦГГ)n. Проведя такой анализ, можно установить точный размер этой области, а значит, и число повторов, и таким способом обнаружить у пациентов премутантные или мутантные аллели. Но нужно сказать, что достичь этого непросто. Исследователи сталкиваются с рядом сложностей при амплификации этих фрагментов. У ДНК, которая будет выступать матрицей для синтеза новых молекул, есть такая характеристика, как ГЦ-состав, отражающая, насколько матрица богата пáрами гуанин-цитозин (богатая матрица содержит примерно 60% ГЦ-пар). Если процент ГЦ-пар высокий, то молекула будет тугоплавкой, и на некоторых этапах ПЦР нужно будет проводить более длительную денатурацию. (ЦГГ)n-область на 100% состоит из пар ГЦ, и ясно, что это очень трудная матрица.
Всё еще более усложняется тем, что такая последовательность без особых усилий образует различные вторичные структуры, очень устойчивые термодинамически: всевозможные шпильки, G-квадруплексы (четыре цепи, связанные между собой гуанинами и поддерживающиеся одновалентным катионом, например K+), i-мотивы (структуры, состоящие из четырех цепей ДНК, богатых цитозином, стабильные в кислой среде) [11]. Изучение подобных структур — очень красивая и интригующая задача для биохимиков и биофизиков, но для установления размера (ЦГГ)n-областей — это серьезное препятствие. Ну и ко всему прочему праймеры (олигонуклеотидные затравки для ДНК-полимеразы) могут образовывать с такими последовательностями димеры, и смесь молекул превращается в один термостабильный нераспутываемый клубок! Ясно, что с такой матрицей просто так не поработаешь. Но! На протяжении нескольких лет ученые активно придумывают всё новые и новые модификации обычной ПЦР, существенно улучшающие результат.
Поскольку ГЦ-богатая матрица нуждается в более длительной и высокотемпературной денатурации, раньше пытались прогревать матрицу дополнительно, перед ПЦР. Однако, как можно догадаться, проблему это не решило. Еще в конце 90-х выяснили, что синтез ДНК прерывается на протяженных участках ЦГГ-повторов в присутствии K+, а чуть позже поняли, что виной тому те самые квадруплексы [12]. Поскольку в наиболее распространенный буфер для ПЦР как раз входит KCl, то самым очевидным решением было исключить его из состава буфера; это дало определенные результаты, но хотелось большего. Поэтому начали активно придумывать альтернативные буферы.
Сейчас часто проводят ПЦР с добавлением чистого Tris-HCl в качестве буфера. Tris —стандартный компонент для получения растворов нуклеиновых кислот: он дешев, и его буферные свойства высоки при рН 7–9 — значениях, физиологичных для живых организмов. В Tris обязательно добавляют хлорид магния в концентрациях, не ингибирующих ДНК-полимеразу и потому не уменьшающих выход специфического продукта. Очень часто смесь «улучшают» разными веществами, изменяющими свойства всей сложной системы ПЦР: ДМСО, бетаин, формамид, — они стабилизируют денатурированную ДНК, помогают снизить температуру плавления. Некоторые используют модифицированные дНТФ, в частности 7-деаза-дГТФ, и отмечают его эффективность (рис. 5); этот модифицированный нуклеотид препятствует формированию сложных дуплексов.
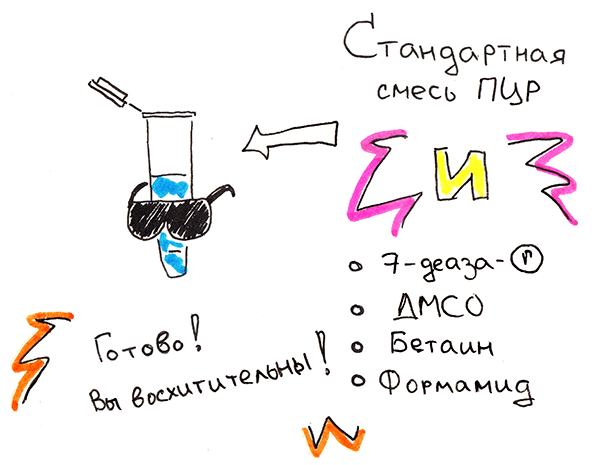
Рисунок 5. Усовершенствованная смесь для ПЦР — первое, что необходимо для амплификации (ЦГГ)n-области.
Кроме компонентов смеси, существуют интересные варианты температурных циклов. Самый простой вариант, часто использующийся для амплификации не самых «труднопроходимых» последовательностей, — ПЦР с горячим стартом (hot-start PCR). Отличие этой модификации от стандартной ПЦР заключается в использовании специальных антител, предотвращающих активацию полимеразы до достижения нужной температуры, что позволяет избежать неспецифического синтеза. Для работы с экстремально ГЦ-богатыми матрицами (>83%) предложен вариант ПЦР под названием Slowdown (модификация Touchdown): медленные скорости нагрева и охлаждения, ступенчатое снижение температуры отжига через определенное количество циклов, добавление 7-деаза-дГТФ — всё это приводит к повышению выхода целевого продукта ПЦР.
Однако нельзя сказать, что проблема получения необходимых для дальнейшего анализа количеств ГЦ-богатых фрагментов (типа промоторной области FMR1) решена полностью: статьи на эту тему появляются часто, но опубликованные результаты противоречат друг другу; коммерческие компании соревнуются в разработке «волшебных» наборов, но стоить они могут настолько дорого, что их не в состоянии себе позволить даже успешные зарубежные лаборатории.
Определение размера (ЦГГ)n-области — это самый первый и очень важный этап в изучении синдрома ломкой X-хромосомы, который, однако, всё еще нуждается в оптимизации. Если мы научимся считать повторы быстро и качественно, то диагностика станет простой и относительно дешевой. Появится возможность проводить ее массово, а значит, отличать синдром ломкой X-хромосомы от множества других заболеваний, сопровождающихся умственной отсталостью, что крайне важно подбора терапевтических подходов.
Литература
- Lubs H.A. (1969). A marker X chromosome. Am. J. Hum. Genet. 21 (3), 231–244
- Budworth H. and McMurrey C.T. (2013). A brief history of triplet repeat diseases. Methods Mol. Biol. 1010, 3–17
- Mirkin S.M. (2007). Expandable DNA repeats and human disease. Nature. 447, 932–940
- Verkerk A.J., Pieretti M., Sutcliffe J.S., Fu Y.H., Kuhl D.P., Pizzuti A. et al. (1991). Identification of a gene (FMR1) containing a CGG repeat coincident with a breakpoint cluster region exhibiting length variation in fragile X syndrome. Cell. 65, 905–914
- Lin S.L. (2015). microRNAs and fragile X syndrome. Adv. Exp. Med. Biol. 888, 107–121
- Hoem G., Raske C.R., Garcia-Arocena D., Tassone F., Sanchez E., Ludwig A.L. et al. (2011). CGG-repeat length threshold for FMR1 RNA pathogenesis in a cellular model for FXTAS. Hum. Mol. Genet. 20, 2161–2170
- Zhao X. and Usdin K. (2015). The repeat expansion diseases: the dark side of DNA repair. DNA repair (Amst.). 32, 96–105
- биомолекула: “Загадочное путешествие некодирующей РНК Xist по X-хромосоме”
- биомолекула: “Истории из жизни Х-хромосомы круглого червя-гермафродита”
- Saldarriaga W., Tassone F., González-Teshima L.Y., Forero-Forero J.V., Ayala-Zapata S., Hagerman R. (2014). Fragile X syndrome. Colomb. Med. (Cali.). 45, 190–198
- биомолекула: “Реалии ДНК-„аномалии“”;
- Usdin K. and Woodford K. (1995). CGG repeats associated with DNA instability and chromosome fragility form structures that block DNA synthesis in vitro. Nucleic Acids Res. 23, 4202–4209